Nuevos hallazgos para tratar esclerosis
- Escrito por Redacción
- Publicado en Pareja saludable
- 0 comentarios
La esclerosis múltiple es una enfermedad que afecta aproximadamente a 20 mil personas en México, con una proporción de 3 casos en mujeres por cada hombre. A pesar de que la mayoría de los casos se diagnostican entre los 20 y los 40 años de edad, se estima que un 10% corresponde a niños.
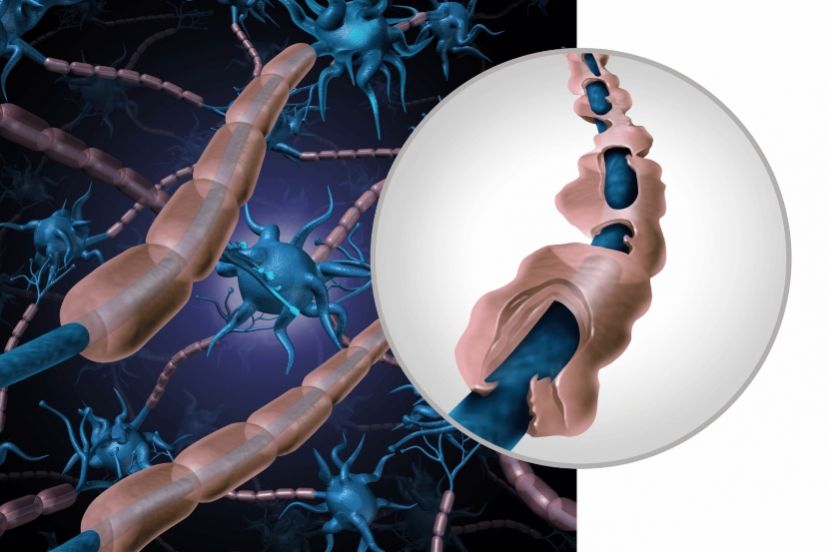
Existen pocas opciones de tratamiento para los niños con esclerosis múltiple, enfermedad en la que el sistema inmunitario ataca la capa protectora de los nervios del cerebro y la médula espinal, y la mayoría de las terapias contra la enfermedad no se han probado en niños.
Un equipo internacional de investigadores, entre los que se encuentran investigadores de Massachusetts General Hospital, ha llevado a cabo un ensayo clínico de fase 3, aleatorizado y a doble ciego, para examinar la seguridad y eficacia de la teriflunomida, un fármaco inmunomodulador oral aprobado en más de 80 países para el tratamiento de adultos con formas recidivantes de esclerosis múltiple.
Según los resultados del ensayo, que aparecen en Lancet Neurology, la teriflunomida fue recientemente aprobada por la Comisión Europea para el tratamiento de niños de 10 a 17 años diagnosticados con esclerosis múltiple remitente recidivante (EMRR).
También puedes leer. Esclerosis múltiple, presentan nueva terapia. https://revistafactorrh.com/pareja-saludable/item/9665-esclerosis-multiple-presentan-nueva-terapia
En el ensayo, denominado TERIKIDS, se asignó aleatoriamente a 109 niños a recibir teriflunomida y a 57 a recibir placebo durante un máximo de 96 semanas (casi dos años). Los pacientes que experimentaron una recaída o mostraron una elevada actividad de la enfermedad en las pruebas de imagen por resonancia magnética (IRM) pudieron entrar antes en una fase de extensión abierta (en la que se garantizó que los pacientes recibieran teriflunomida) antes de que finalizara el periodo doble ciego.
Es importante destacar que más pacientes de lo previsto del grupo placebo entraron en la fase de extensión abierta (debido a la elevada actividad de la IRM), con un 26% de pacientes que cambiaron de placebo a teriflunomida antes de las 96 semanas.
Tras 96 semanas, no hubo diferencias en el tiempo transcurrido hasta la primera recaída clínica de la esclerosis múltiple con teriflunomida en comparación con placebo. La teriflunomida fue bien tolerada; se produjeron acontecimientos adversos graves en el 11% de los pacientes del grupo de teriflunomida y en el 11% de los pacientes del grupo placebo.
La inflamación nasal, la infección del tracto respiratorio superior, la caída del cabello, las sensaciones de hormigueo, el dolor abdominal y el aumento de la creatina fosfoquinasa en sangre (un marcador de daño muscular) fueron más frecuentes con teriflunomida que con placebo.
"El ensayo no alcanzó su criterio de valoración primario (lo que retrasó la siguiente recaída clínica) posiblemente debido a los cambios más frecuentes a la rama abierta a causa de la elevada actividad de la IRM. Sin embargo, el estudio sí cumplió varios criterios de valoración secundarios clave, relacionados con la capacidad de la teriflunomida para reducir el número de lesiones nuevas o agrandadas detectadas mediante IRM, lo que sugiere que la medicación podría tener efectos beneficiosos en niños con formas recidivantes de esclerosis múltiple", dijo la autora principal, Tania Chitnis, directora del Centro Mass General Brigham de Esclerosis Múltiple Pediátrica de Mass General for Children.
Chitnis señaló que continúa un estudio abierto de extensión del tratamiento para evaluar los efectos a largo plazo de la teriflunomida en pacientes jóvenes.